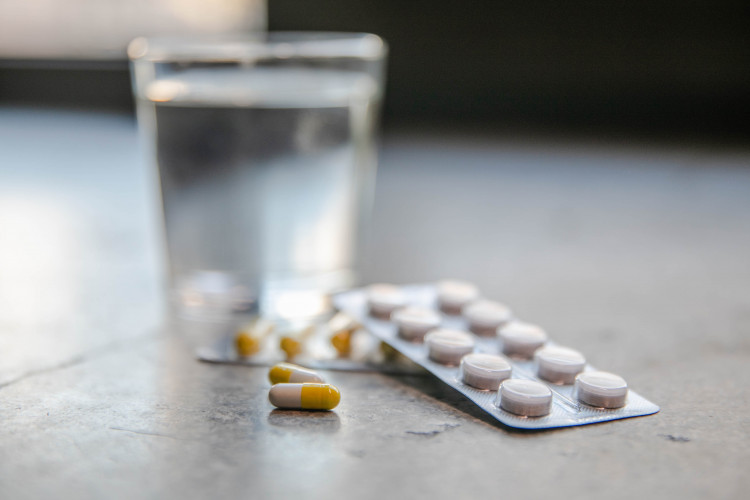
Nye krav til lægemiddelproducenter om anvendelse af en entydig identifikator og en anordning til kontrol af, om emballagen er blevet brudt.
Nye EU-regler om forfalskede lægemidler introducerer to nye sikkerhedsforanstaltninger, som emballagen på de fleste former for receptpligtige lægemidler skal forsynes med, nemlig (i) en unik identifikator og (ii) en anordning til kontrol af, om emballagen er blevet brudt.
Kommissionens Delegerede Forordning beskriver sikkerhedselementernes karakter, hvordan lægemidlers ægthed kontrolleres og af hvem. Sikkerhedskravene trådte i kraft den 9, februar 2019.
Sikkerhedselementerne
Den unikke identifikator indeholder følgende dataelementer:
- Produktkode
- Serienummer
- Nationalt tilskudsnummer
- Batchnummer
- Udløbsdato
Hverken Direktiv om forfalskede lægemidler eller den Delegerede Forordning oplyser noget specifikt om kontrolanordningen. Der er ingen lovpligtig specifikation, men kontrolanordningen skal gøre det muligt at kontrollere, hvorvidt emballagen på et lægemiddel er blevet brudt.
Kontrolsystem
Sikkerhedselementerne er kombineret med et start-til-slut EU-kontrolsystem (datalagringssystem), som gør de relevante interessenter i stand til at kontrollere lægemidlets ægthed.
Indehavere af markedsføringstilladelser er forpligtet til at sikre, at oplysninger angående den unikke identifikator uploades til systemet, før lægemidlet frigives til salg, samt at oplysningerne holdes opdaterede. Ved levering af lægemidler til offentligheden, til apoteker, hospitaler og sundhedsinstitutioner skal de kontrollere sikkerhedselementerne og "deaktivere" den unikke identifikator.
Såfremt der er grund til at tro, at lægemidlets emballage er blevet brudt, eller hvis kontrollen af sikkerhedselementerne viser, at lægemidlet muligvis ikke er ægte, skal de relevante kompetente myndigheder straks underrettes.
Kommentarer
Forfalskede lægemidler bliver stadigt mere sofistikerede og svære at kontrollere. De nye sikkerhedsforanstaltninger garanterer lægemidlets ægthed til gavn for patienter og virksomheder. De nye EU-regler fører dog også til mere administrativt arbejde hos lægemiddelvirksomhederne. Bech-Bruun's life sciences team følger udviklingen inden for området og er parat til at hjælpe med regulatoriske spørgsmål.
Gå ikke glip af vigtig juridisk viden - Tilmeld dig vores gratis nyhedsservice
her →
Har du spørgsmål til dette indlæg, er du mere end velkommen til at kontakte os.